一项研究描述了导致疟疾寄生虫恶性疟原虫将资源投入繁殖(以最大限度地向其他宿主传播或复制)以确保在其当前人类宿主中生存的因素。
该研究结果发表在eLife上,由KEMRI-WellcomeTrust和格拉斯哥大学的研究人员领导,进一步阐明了疟疾寄生虫如何因传播强度的变化而适应不断变化的人类环境——一种衡量疟疾水平的指标。疟疾寄生虫在特定地区的传播。
研究表明,低传播期间人体对疟疾感染的炎症反应与血浆中一种叫做溶血磷脂酰胆碱(LPC)的化学物质水平降低有关。这些低水平的LPC通过增加有性繁殖和减少无性复制来增加寄生虫对传播到另一个宿主的投资。
疟疾是世界上最大的公共卫生问题之一;2021年,估计有619,000人死亡和2.47亿例病例。大约70%的疟疾死亡发生在非洲五岁以下的儿童身上,并且是由一种寄生虫恶性疟原虫引起的。为了从一个人类宿主传播到另一个人类宿主,寄生虫必须首先转移到蚊子身上。这需要寄生虫分化成称为配子体的特殊细胞——这些细胞最终成为有性繁殖所必需的配子。
“恶性疟原虫有一个复杂的生命周期,涉及人体血液中的无性复制,以及分化成传播给蚊子所需的配子体,”肯尼亚基利菲KEMRIWellcomeTrust研究计划的高级研究科学家、主要作者AbdirahmanAbdi解释道。肯尼亚基利菲Pwani大学Pwani大学生物科学研究中心。
“已知配子体的分化以寄生虫中称为ap2-g的基因的激活为标志。然而,导致该基因激活的因素以前并未得到很好的表征。”
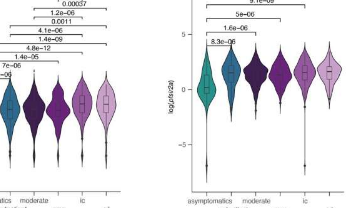
为弥补这一差距,Abdi及其同事分析了1994年至2014年间肯尼亚基利菲828名患有重度、轻度和无症状疟疾的儿童的数据。在这一队列中,他们检查了宿主免疫反应和新陈代谢的标志物,并比较了寄生虫生长和传播的标志物投资。
特别是,他们检查了两个寄生虫基因:ap2-g(配子体激活所需的转录因子)和PfSir2a(与抗原变异和复制的调节相关的环境传感器),以及寄生虫生物量的标记。一起研究这些参数使团队能够在不断变化的传播强度和宿主免疫力的背景下确定寄生虫投资。
补充最近的研究,他们发现在较低的传输强度下,ap2-g以较高的速率被激活。进一步分析表明,这种ap2-g激活与配子体标记物Pfs16的激活增加密切相关,证实ap2-g激活导致配子体生产投资增加。发现ap2-g和PfSir2a的水平随着人体宿主体内的发烧而增加,这表明配子体的产生对宿主炎症免疫反应的变化很敏感。
该团队之前已经表明,在实验环境中,疟疾寄生虫的无性复制(和抑制配子体产生)需要一种称为LPC的化合物。因此,他们接下来试图在患者队列中验证这一发现。他们对队列中代表性子集的血浆进行了分析,以探索宿主炎症免疫反应如何影响LPC水平,进而影响ap2-g和PfSir2a水平。
人类宿主中的高水平炎症被发现与较低水平的LPC相关,因此减少了可用于寄生虫复制的营养物质。还发现低水平的LPC与ap2-g激活和增加的PfSir2a表达有关,表明恶性疟原虫能够感知LPC水平。
当人类宿主的炎症严重且LPC耗尽时,寄生虫会投资于配子体的产生,以便传播给蚊子并找到另一个人类宿主,因为配子体需要较少的营养资源并代表更可行的生存策略。
“我们提出了一个模型,其中宿主免疫力下降和传播强度下降会改变寄生虫的宿主环境,从而导致寄生虫在传播方面的投资增加并限制复制,”资深作者、威康综合寄生虫学中心教授MatthiasMarti总结道,英国苏格兰格拉斯哥大学感染与免疫研究所,以及瑞士苏黎世大学Vetsuisse和医疗机构寄生虫学研究所。
“我们的研究结果为准确模拟寄生虫动力学提供了关键信息,特别是在低传播强度下。这可以为成功消除疟疾寄生虫提供时间表,并且还为一旦成功减少传播可能使用杀配子细胞药物提供了有力的论据。”
