酶在所有活生物体的细胞中发挥作用,可以很容易地进行特定和复杂的反应。然而,很少有天然酶对工业应用有效,工业应用可以从使靶向酶创造成为现实的发现中受益匪浅。
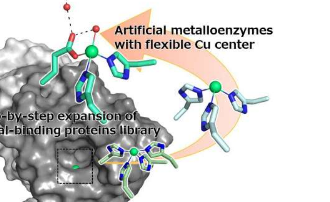
人工金属酶可以简单地通过将金属离子或金属化合物与蛋白质结合来产生,从而使它们表现出酶活性。目前,正在研究金属酶以发现新功能或与天然酶相比提高其反应性。尽管如此,金属酶的反应机制在很大程度上仍然是未知的,这使得设计具有特定功能或提高效率的人工酶非常困难。
大阪都市大学农学研究生院NobutakaFujieda教授领导的一个研究小组一直在使用小型耐热金属结合蛋白制造人工金属酶。在他们的最新研究中,他们描述了一种他们简单地创造的人造金属酶,利用2-His-1-carboxylate金属结合基序,这在非血红素金属酶中很常见。研究结果于2023年3月13日发表在ChemicalScience上。
他们新的人造金属酶有一个由四个氨基酸组成的金属结合位点,最初是组氨酸。该研究小组对这些氨基酸进行了突变,以创建一个包含12种略有不同的蛋白质的文库以进行比较。在筛选文库后,他们发现酶变体H52A/H58E在与铜离子结合时具有最佳的立体选择性,因此它可以选择性地与目标分子的正确版本发生反应。
研究小组随后对金属结合位点进行了X射线晶体学分析,确认了来自铜离子的两个电子密度。此外,两个铜离子的对接模拟发现,稍微突出的铜可以结合到基板上,这使该小组相信,通过铜离子移动到最有可能结合基板的位置,选择性最大化。
“在天然酶中也观察到了金属离子的这种位置转变,因此我们相信对我们的人造金属酶反应机制的详细分析将加深我们对天然酶的了解。我们希望这项研究的进展将导致创造可以在温和条件下工作的生物催化剂,”藤枝教授总结道。
