在《科学进展》杂志发表的一项研究中,中国科学院上海生物化学与细胞生物学研究所分子细胞科学卓越中心姚丛博士团队报道了TRiC辅助微管蛋白/肌动蛋白折叠的全貌通过低温电子显微镜(cryo-EM)分析,在共伴侣plp2的协调下,TRiCATPase循环。
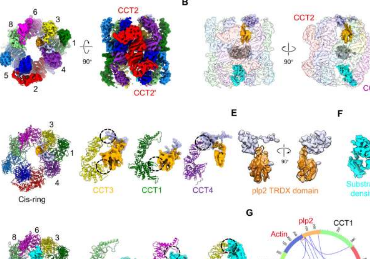
真核生物组II伴侣蛋白TRiC/CCT通过ATP驱动的构象环协助折叠约10%的胞质蛋白,包括许多关键的结构和调节蛋白,例如关键的细胞骨架蛋白微管蛋白和肌动蛋白、细胞周期调节因子CDC20和许多参与肿瘤发生的蛋白质。因此,TRiC在维持细胞蛋白质稳态方面起着至关重要的作用。TRiC功能障碍与癌症和神经退行性疾病密切相关。
主要的细胞骨架蛋白微管蛋白和肌动蛋白是TRiC的专性底物。一种非常复杂的细胞机制,最少由TRiC、辅伴侣和辅因子组成,已经进化到促进它们的生物发生。已经表明,phosducin样蛋白2(PhLP2)对于纤毛发生和微管组装至关重要,纤毛前体微管蛋白需要在PhLP2的协助下由TRiC折叠。
研究人员首先确定了S.cerevisiaeTRiC沿其ATPase循环的低温EM结构集合,同时在其腔室内结合了plp2和底物肌动蛋白或微管蛋白,每个环一个,分辨率高达3.05Å,在开放环境中S1/S2状态、plp2和微管蛋白/肌动蛋白在相反的TRiC腔内接合,底物密度仍然不太好分辨,表明它可能处于折叠的初始阶段。
有趣的是,研究人员捕获了一个前所未有的处于闭合S3状态的TRiC-plp2-微管蛋白复合体,它与一个完全折叠的全长β-微管蛋白结合,自从它从TRiC室“诞生”以来,它甚至加载了一个GTP,而一个plp2占据对面的戒指。这为微管蛋白的生物合成和a/b-微管蛋白异二聚体的组装提供了新的线索。另一个关闭的S4状态揭示了处于中间折叠状态的肌动蛋白和plp2。
伴随TRiC环闭合,一个环中的plp2易位可以协调对面环的CCT6半球上的底物易位,促进底物稳定和折叠。此外,无论TRiC的构象状态如何,共伴侣plp2都参与TRiC的腔内,但观察到TRiC的其他共伴侣如PFD和PhLP1仅结合在开放的TRiC环的外顶部。
本研究提供了对复杂生物发生机制TRiC和plp2协调下主要细胞骨架蛋白微管蛋白/肌动蛋白折叠机制的结构性见解,并可以扩展对细胞骨架蛋白质稳态与相关人类疾病(如发育和神经系统疾病)之间联系的理解.
