日本国立自然科学研究所和名古屋市立大学的研究人员通过阐明与神经细胞表面糖脂结合的β淀粉样蛋白(Aβ)的结构,取得了重大突破。这一发现揭示了异常Aβ原纤维形成的关键作用(阿尔茨海默氏病的主要诱因),并为医学和药学的创新进步带来了希望。
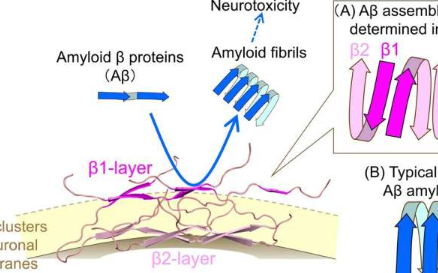
阿尔茨海默病的特点是Aβ异常聚集成淀粉样原纤维,并在大脑中积聚。了解Aβ原纤维形成的分子机制对于医学和药学领域至关重要。为了解决这个问题,研究人员重点研究了Aβ与神经元细胞膜上称为GM1神经节苷脂的糖脂的相互作用。
研究小组利用固态核磁共振波谱和分子动力学模拟,发现Aβ与膜表面的GM1神经节苷脂结合后呈“U”形构象。这种“U”形Aβ结构由两层组成,即β1层(远离膜)和β2层(靠近膜),交替排列。
与之前报道的沿统一方向排列的Aβ淀粉样原纤维相比,含有GM1神经节苷脂的膜上的Aβ组装表现出完全不同的构象。值得注意的是,膜表面高度暴露的β1层被发现充当催化剂,显着加速周围Aβ分子的原纤化。此外,专门观察到抗GM1-Aβ抗体识别该区域。
这项研究成功揭示了Aβ的三维结构,在神经元细胞膜上存在GM1神经节苷脂的情况下,Aβ充当淀粉样原纤维形成的催化平台。虽然已经开发了多种针对Aβ聚集体的治疗性抗体,但它们主要与淀粉样原纤维或其前体结合。本研究中发现的独特Aβ结构提供了新的可能性,因为抗GM1-Aβ抗体能够识别并结合这种独特的构象。
因此,这项研究首次鉴定了负责在脑组织中产生淀粉样原纤维的结构实体,可能为预测阿尔茨海默病的发病风险提供见解,并为抑制其进展开辟途径。本研究揭示的Aβ分子的三维结构为开发针对阿尔茨海默病的新治疗策略提供了令人兴奋的前景。
该成果发表在《ACS化学神经科学》杂志上。
