在探索杀伤性T细胞如何产生增殖所需原材料的一个方面,路德维希癌症研究中心的一项研究发现,免疫细胞的新陈代谢、基因表达调节、持久性和功能功效之间存在意想不到的联系,可以利用现有技术来利用这种联系。改善癌症免疫治疗的药物。
由LudwigLausanne的AlisonJaccard和Ping-ChihHo领导的研究人员以及他们在洛桑大学的同事MathiasWenes和PedroRomero正在探索肿瘤低氧环境中增殖的T细胞如何产生柠檬酸盐,柠檬酸盐是制造膜所必需的分子。需要大量制造新细胞。
问题在于,杀伤性(CD8+)T细胞(可消灭患病和受感染的细胞)是否使用癌细胞增殖所采用的技巧来确保在类似缺氧条件下稳定供应关键分子:通过一系列物质分流氨基酸谷氨酰胺化学反应,包括一种称为还原羧化的化学反应,以制造柠檬酸盐。
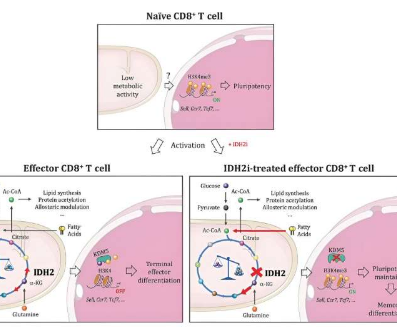
Ho说:“我们在这项研究中表明,CD8+T细胞确实参与了这一代谢途径,并且一种广泛表征的代谢酶(异柠檬酸脱氢酶)在该过程中发挥着核心作用。”
“但真正令我们惊讶并且对癌症免疫疗法可能具有重要意义的是,从遗传或药理学角度破坏这种酶并没有像我们预期的那样阻碍CD8+T细胞的增殖或功能。相反,它导致了它们的后代转化为记忆T细胞,这些细胞比它们的前辈更有活力,寿命也更长。”
研究人员在最新一期《自然》杂志上进一步报道,在抑制异柠檬酸脱氢酶(IDH2)的药物存在下生长的小鼠和人类嵌合抗原受体(CAR)T细胞都具有记忆T细胞的所有关键特性。他们还证明,这些CAR-T细胞经过改造,可靶向癌细胞上的特定标记,在黑色素瘤、白血病和多发性骨髓瘤小鼠模型中显示出增强的抗肿瘤活性。
Jaccard说:“当CD8+T细胞准备用于涉及过继细胞转移的治疗时,它们往往会相对耗尽,这意味着它们的增殖能力有限,并且在激活后很快就会死亡。”“这导致它们的植入效率低下和癌症复发。但记忆T细胞会持续存在,并且在被靶标激活时可以一次又一次地增殖,这使得它们成为CAR-T和其他过继性细胞疗法的更好工具。”
对破坏IDH2活性如何影响T细胞的分析揭示了T细胞中代谢物谱的改变与其基因表达的表观遗传调控之间的联系,其中DNA及其蛋白质包装的化学标记动态地改变染色体结构,以确定基因的可用性用于阅读。
Jaccard说:“我们的研究表明,当IDH2被药物抑制时,细胞会利用替代代谢途径进行补偿。”“这自然会改变细胞中产生的代谢物的类型和数量,而受这些变化影响的一些代谢物涉及表观遗传酶的调节。这就是驱动CD8+T细胞转化为记忆细胞的原因。”
具体来说,IDH2抑制会影响称为TCA循环的核心代谢过程,迫使T细胞激活补偿代谢途径。这改变了细胞中代谢物的分布,提高了抑制表观遗传酶KDM5的分子水平,从而改变了关键表观遗传“标记”在染色体上的沉积。
结果,染色体以某种方式打开,使细胞的基因表达机制能够接触到定义记忆T细胞的基因,从而触发它们的转化。在没有IDH2抑制的情况下,这些基因会被隐藏起来,从而增强了最终耗尽的CD8+T细胞的身份。
除了实际应用之外,这些发现还表明,CD8+T细胞的增殖不需要还原性羧化,而快速生长的癌细胞似乎需要还原性羧化。相反,代谢过程会启动基因表达程序,将免疫细胞锁定在终末效应器状态——在这种状态下,它们保留功能能力,但它们的寿命和增殖能力会被缩短。
Ho表示,他的团队现在计划研究如何最好地破坏还原性羧化,为CAR-T和其他过继性T细胞疗法准备更好的细胞,并比较药理学抑制与基因编辑策略。他和他的同事还将探索癌细胞是否能够适应劫持T细胞的新陈代谢和表观遗传调控,从而将它们推入不太持久的终末效应状态。
